


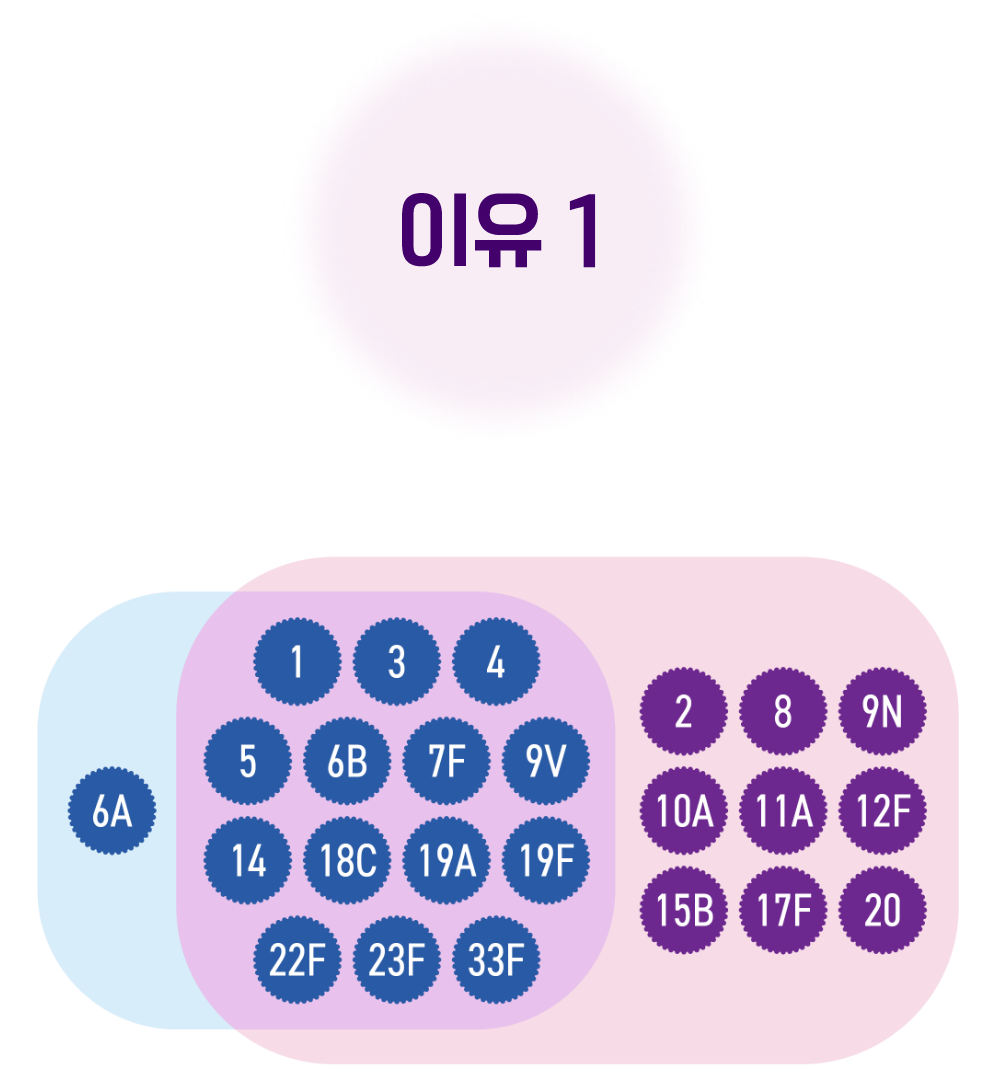
폭넓은 혈청형
15가/23가 폐렴구균 백신 순차 접종 시
더 넓은 범위의 백신 포함 혈청형으로 인한
폐렴구균 질환 예방이 가능합니다.2

국내외 백신 접종 권고안
대한감염학회 및 미국 질병통제예방센터
예방접종자문위원회에서는
65세 이상의 건강한 성인과
19세 이상의 고위험군#에 대해
15가/23가 폐렴구균 백신 순차 접종을 권고하고 있습니다.2,3
※ 프로디악스®23은 2세 이상의 고위험군† , 50세 이상 성인의 백신 포함 폐렴구균 협막형에 의한 폐렴구균 질병 예방에 대한 허가를 받았으며, 다른 백신과 마찬가지로 이 백신의 모든 피접종자에서 완전한 예방 효과를 보이지 않을 수 있습니다.
* 뇌척수액 누수, 인공 와우 삽입, 기능적 해부학적 무비증 환자 포함 # 만성질환자 및 면역저하자 등
† 기능적 또는 해부학적 비장결손 (예: 겸상적혈구증 또는 비장적출), HIV 감염, 백혈병, 림프종, Hodgkin병, 다발성 골수종, 전신암, 만성신부전, 신증후군, 기타 면역억제와 관련있는 상태 (예: 장기 또는 골수이식), 면역억제 화학요법 (장기간의 전신 코르티코스테로이드 투여 등)을 받고 있는 사람
KSID : Korean Society of Infectious Diseases, CDC : Centers for Disease Control and Prevention
References 1. 질병관리청. 예방접종도우미. HOME> 예방접종 길잡이>국가 예방접종 사업 소개>어르신 폐렴구균 예방 접종사업. Available at <https://nip.kdca.go.kr/irhp/infm/goVcntInfo.do?menuLv=1&menuCd=135> Accessed Jan. 6, 2025. 2. 대한감염학회. HOME>자료모음>성인예방접종 가이드라인>성인예방접종 개정안>2025년>폐렴알균. Available at <https://www.ksid.or.kr/introduce/file/vaccine_rule_2025_02.pdf> Accessed Mar. 18, 2025. 3. Kobayashi M, et al. Pneumococcal Vaccine for Adults Aged ≥19 Years: Recommendations of the Advisory Committee on Immunization Practices, United States, 2023. MMWR Recomm Rep. 2023 Sep 8;72(3):1-39.
※ 부작용이 있을 수 있으니 「사용상의 주의사항」을 잘 읽고 의사, 약사와 상의하십시오. 인터넷 의약품 판매행위는 불법입니다.
광고심의필 2025-1765-105200
광고심의필 2025-1769-104204
PRODIAX® 23 프리필드시린지 주요 안전성 정보 (Selected Safety Information) [효능·효과] 백신 함유 폐렴구균 협막형에 의한 폐렴구균질병의 예방 이 백신의 폐렴구균에 의한 폐렴 및 균혈증 예방의 유효성은 남아프리카 및 프랑스에서 수행된 대조임상시험과 환자대조군 연구(case-control study)들에서 입증되었다. [용법·용량] 정맥 또는 피내주사 하지 말 것. 통상 1회 0.5 mL을 피하주사 또는 근육주사 한다. (삼각근 또는 대퇴측부에 주사하는 것이 바람직하다). 정맥주사가 되지 않도록 충분히 주의한다. 이 백신은 무색투명한 액상제제이며 희석 또는 용해할 필요 없이 바로 주사한다. 이 백신은 보존제로0.25%의 페놀을 포함하며 유효기한이 지난 백신은 폐기해야 한다. 특정 접종시기 -이 백신은 비장적출수술 예정이 있는 경우 가능한 적어도 2주 전에 접종해야 한다.- 암치료를 위한 화학요법이나 다른 면역억제요법(예: Hodgkin이 있거나 장기 또는 골수이식을 받는 경우)을 계획중인 사람은 이 백신접종과 면역억제요법의 개시 사이에 최소 2주 이상의 간격을 두어야 한다. -화학요법 또는 방사선요법 중에는 백신접종을 피해야 한다. 문헌보고에 의하면, 종양치료를 위한 화학요법이나 방사선요법 완료 수개월 후에 이 백신을 접종할 수 있다.- Hodgkin병의 경우, 집중적인 화학요법(방사선요법 여부에 관계없이 후에 2년 이상 동안 백신접종에 대한 면역반응은 저하될 수 있다. 화학요법 또는 다른 면역억제요법 완료 후 2년간, 일부 환자에서 치료완료와 백신접종 사이의 간격이 길어질수록 항체반응의 증가가 관찰되었다. -HIV 감염환자는 증상의 유무와 관계없이 진단이 확정된 후 가능한 한 빨리 이 백신을 접종 받아야 한다. [사용상의 주의사항] [경고] 1) 암치료를 위한 화학요법이나 다른 면역억제요법(예: Hodgkin 병이 있거나 장기 또는 골수이식을 받는 경우)를 계획중인 사람은 이 백신의 접종시기가 중요하다(용법·용량,특정 접종시기 참조) 2) 면역억제 치료중인 환자에서는 기대한 혈청항체반응이 나타나지 않을 수 있으며 향후 폐렴구균 항원에 대한 면역반응에 있어 잠재적인 손상을 가져올 수 있다(용법·용량, 특정 접종시기 참조). 3) 피내주사는 심한 국소부위 이상반응을 야기시킬 수 있다. [금기] 이 백신의 성분에 과민증상이 있는 사람. 이 백신의 성분에 의한 급성 아나필락시스 반응이 발생할 경우 즉시 에피네프린(1:1,000) 주사를 투여한다. [신중투여] 화학요법, 방사선요법 또는 기타면역억제제 등으로 치료중이거나, 면역기능이 현저히 저하된 사람 [유해사례] 이 백신의 임상시험에서 가장 흔하게 보고된 유해사례는 다음과 같다: -동통, 홍반/발적, 열감, 부종, 경결 등의 주사부위 국소반응- 38.9°C 이하의 발열. 임상시험 및/또는 시판 후 보고된 기타 이상반응들은 아래와 같다: 전신 및 주사 부위 연조직염 무력증 권태감 발열(>38.9°C) 오한 통증 팔다리 운동성 감소 사지 접종부위의 말초 부종 소화기계 구역 구토 혈액/림프계 림프절염 림프절병증 소강기에 있는 특발성 혈소판감소성 자반병 환자에서의 혈소판감소증 다른 혈액질환을 앓은 적이 있는 환자에서의 용혈성 빈혈 백혈구증가증 과민반응 아나필락시스 반응 혈청이상(serum sickness) 혈관신경부종 근골격계 관절통 관절염 근육통 신경계 두통 감각이상 신경근병증 길랑-바레 증후군 열성 경련 피부 발진 두드러기 다형 홍반. 이 백신의 시판 후 조사에서 주사부위 연조직염 유사반응이 드물게 보고되었다. 이러한 연조직염 유사반응은 최초 및 추가 접종에서 백신접종 후 약 2일(중간값) 후에 발생했다. 발열 및 백혈구증가증을 포함하는 전신 징후 및 증상과 임상검사치인 혈청 C-reactive protein의 증가는 국소 이상반응과 관련이 있을 수 있다. 이 백신의 시판 후 일부 고령자에서 백신 투여 시 중증의 유해사례 및 복잡한 임상 경과를 경험하였다는 보고가 있었다. 예를 들어, 일부 다양한 정도의 의학적인 기저 질환이 있는 피험자가 입원 치료를 필요로 하는 국소 반응 및 발열과 관련된 임상 악화를 경험하였다(고령자에 대한 투여 항 참조). 임상시험에서, 1차 접종으로부터 3~5년 후 재접종시 국소 이상반응의 증가가 관찰되었다. 65세 이상의 피험자에서 전체 주사부위 유해사례 보고율은 1차 접종시(52.9%)보다 재접종(79.3%)에서 더 높게 보고되었다. 50세~64세의 피험자에서 전체 주사부위 유해사례 보고율은 1차 접종시와 재접종시 유사하였다(각각 72.8% 및 79.6%). 두 연령군 모두에서 재접종시 종합 평가변수(다음 중 하나 이상을 보고: 중등도의 통증, 심한 통증 및/또는 주사부위의 넓은 경결)가 1차 접종 환자에서보다 많이 보고되었다. 65세 이상 피험자군에서는 종합 평가변수가 1차 접종시 10.4%, 재접종시 30.6%이었고, 50세~64세의 환자군에서는 1차 접종시 18.9%, 재접종시 35.5%이었다. 주사부위반응은 3일간의 관찰기간 중 발생하였고 일반적으로 5일 이내에 회복되었다. 각 연령군에서 1차 접종자와 재접종자 사이의 전신 유해사례 보고율은 유사하였다. 백신과 관련 있는 전신 유해사례 보고율은 65세 이상 환자군에서는 1차 접종(21.7%)보다 재접종(33.1%)시 더 높았고, 50세~64세 환자군에서는 유사(1차 접종군에서 35.5%, 재접종군에서 37.5%)하였다. 이 백신 접종 후 가장 흔하게 보고된 전신 유해사례는 다음과 같다: 무력증/피로, 근육통, 두통. 연령과 관계 없이, 백신 접종 후 관찰되었던 진통제 사용 증가(1차 접종자에서 4% 이하, 재접종자에서 13% 이하)는 5일째까지 기저치로 회복되었다. [일반적 주의] 1) 함유하는 협막형 이외형의 폐렴구균에 의한 감염에 대해서는 효과가 없다. 2) 다른 백신과 마찬가지로, 이 백신의 모든 피접종자에서 완전한 예방효과를 보이지 않을 수 있다. 3) 전신 이상반응이 중대한 위험을 일으킬 수 있는 중증의 심혈관계 및/또는 폐 기능손상 환자에게 이 백신을 접종할 때는 반드시 주의와 적절한 조치를 취해야 한다. 4) 열성 호흡기 질환 또는 다른 활동성 감염 시 이 백신의 접종을 보류한다. 단, 의사가 백신투여를 보류하는 것이 더 큰 위험을 초래한다고 판단한 경우는 예외이다. 5) 페니실린(또는 다른 항생제)을 통한 폐렴구균의 감염 예방조치를 필요로 하는 환자들은 이 백신의 접종 이후에도 이러한 예방조치를 중단해서는 안 된다. 6) 이 백신은 선천적 상해, 두개골 골절, 또는 신경외과적 수술 등으로 인한 만성 뇌척수액(CSF) 누출이 있는 환자의 폐렴구균성 뇌수막염을 예방하는 데는 효과적이지 않을 수 있다. [상호작용] 1) 이 백신은 유해사례의 증가나 항체 반응의 감소 없이 인플루엔자 백신과 동시에(서로 다른 팔에 각각 접종) 접종할 수 있다. 2) 무작위배정 임상시험에서 이 백신과 대상포진 생바이러스 백신을 동시에 접종한 피험자와 4주의 간격을 두고 접종한 피험자를 비교하였을 때, 두 백신을 동시에 접종한 피험자에서 gpELISA로 측정한 대상포진 생바이러스 백신의 면역원성 감소가 관찰되었다. 최소 4주의 간격을 두고 두 백신을 접종할 것을 고려하여야 한다. [임부] 이 백신이 생식능에 영향을 미치는지에 대한 동물시험은 수행되지 않았다. 이 백신이 임부에게 접종되었을 경우 태아에게 위해를 끼치는지 또는 생식능에 영향을 미치는지에 대해서는 알려져 있지 않다. 이 백신은 명확하게 필요할 경우에만 임부에게 주사하여야 한다. [수유부] 이 백신이 모유를 통해 분비되는지는 알려져 있지 않다. 이 백신을 수유부에게 접종할 경우에는 주의하여야 한다. [소아] 이 백신은 2세 미만의 소아에게는 권장되지 않는다. 2세 미만 소아에 대한 안전성과 유효성은 확립되지 않았다. 이 연령기의 소아는 이 백신에 함유된 협막형에 반응성이 약하다. [고령자] 65세 이상의 피험자가 이 백신의 허가 후에 진행된 몇몇 임상시험에 등록되었다. 대부분의 임상시험에서 65세 이상의 연령군(N=629)과 50~64세 연령군(N=379)에서 이 백신의 안전성을 비교하였다. 이 시험에 등록된 피험자는 만성 질환을 가지고 있었으나 안정적인 상태를 유지하고 있었으며, 50~64세 피험자 중 86.3%, 65~91세 피험자 중 96.7%가 등록 시점에 최소 1가지 이상의 의학적 질환을 가지고 있는 것으로 보고되었다. 백신 관련 전신 유해사례는 65세 이상의 피험자에서 1차 접종 시(21.7%)보다 재접종(33.1%)에서 더 높게 보고되었으며, 50~64세 피험자에서는 1차 접종 시(35.5%)와 재접종(37.5%)시 유사하게 나타났다. 고령자는 비고령자보다 의학적 처치에 대한 내약성이 떨어질 수 있으므로, 일부 고령자에서 반응 빈도가 높아지거나 반응 정도가 심해질 가능성을 배제할 수 없다. 이 백신의 시판 후 일부 고령자에서 백신 투여 시 중증의 유해사례 및 복잡한 임상경과를 경험하였다는 보고가 있었다. 예를 들어, 일부 다양한 정도의 의학적인 기저질환이 있는 피험자가 입원 치료를 필요로 하는 국소 반응 및 발열과 관련된 임상악화를 경험하였다. [임상검사치에의 영향] 임상시험 및/또는 시판 후 보고된 임상검사치 유해사례는 다음과 같다: 혈청 C-reactive protein 증가. (개정일 : 2021.01.26)
※ 보다 자세한 정보는 의료전문인과 상의하시기 바랍니다.
KR-PNX-00298 02/2027
Copyright © 2025 Merck & Co., Inc., Rahway, NJ, USA and its affiliates. All rights reserved. 우)04637 서울특별시 중구 한강대로 416 서울스퀘어 23층 한국엠에스디(주) (전화) 02-331-2000 https://www.msd-korea.com
Copyright © 2025 by Boryung Biopharma Co., LTD All right reserved. 우)05203 서울특별시 강동구 고덕비즈밸리로 2길 45 (고덕동) 5층 (주)보령바이오파마 (전화) 02-6072-2500 https://www.boryungbio.co.kr


